研究テーマ 1


研究テーマ 1


生命の本質を調べる;
生体膜脂質ラフトの作動メカニズムの解明
研究の目的
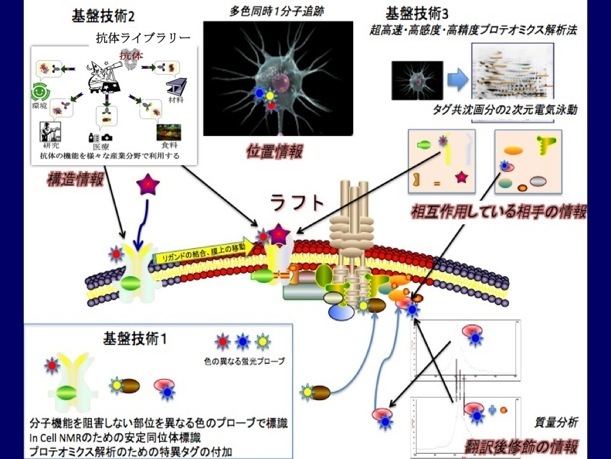
細胞が多様な状況に迅速かつ適切に対処するために、生体膜上でドラスティックかつ局所的に生成、消滅する、様々な蛋白質と脂質からなる機能場(ラフト、生体膜マイクロドメイン)が、シグナル受信の最前線における迅速かつ適切なシグナル処理のために機能していることが最近の研究で徐々に明らかになりつつある。その生理機能の理解には、実際に各細胞で活動しているラフトをリアルタイムで観察し、その構成因子の変化や、各因子の翻訳後修飾や相互作用相手の状態を把握する必要がある。
そのために、これまでに独自に開発した、タンパク質の任意の部位に任意のプローブを導入する技術(基盤技術1)、人工抗体によりラフトを操作する(基盤技術2)、超高速・高感度・高精度プロテオミクス解析法(基盤技術3)を組み合わせて、細胞内のタンパク質1分子の位置、立体構造、相互作用している分子をとことん追跡することで、細胞をマイクロラボ化する実験系を構築している。
本研究では、神経細胞のラフトの動態をマイクロラボ化した細胞で調べることにより、神経での細胞内シグナル伝達系の最前線でのシグナル処理の仕組みを明らかにする。ラフトを構成していることが既に知られている受容体、カルモジュリン(CaM)などの制御因子、神経細胞に特異的に発現していてラフトに一過的に局在することが知られているNAP22やMARCKSなどのミリストイル化タンパク質を異なった色と安定同位体プローブで標識して、細胞の状態に応じてそれらの挙動がどう変わるかを調べるとともに、それらと恊働する未知の因子を同定する。
ミリストイル化(長鎖飽和脂肪酸ミリスチン酸が付加される翻訳後修飾)蛋白質の機能ドメインにおいて細胞膜との相互作用、CaMとの相互作用、プロテインキナーゼC(PKC)によるリン酸化がそれぞれ排他的に起こることを、ニューロン特異蛋白質NAP22、HIVnef遺伝子産物、Srcキナーゼで見出した。ミリストイル化蛋白質はミリストイル基をアンカーにして膜に結合するが、カルシウム結合型CaMとの相互作用や、リン酸化により膜画分から細胞質へ移行する。しかしながら、CaMの解離や、脱リン酸化により、再び膜画分へ移行する。ミリストイル化蛋白質は、細胞の状態に感応して膜画分と細胞質を可逆的に移行することで、ふたつの領域のシグナル伝達を担っている。近年、細胞が多様な状況に迅速かつ適切に対処するために、生体膜上でドラスティックかつ局所的に生成、消滅する、様々な蛋白質と脂質からなる機能場(ラフト)が、シグナル伝達を始めとする様々な機能を担っていることが明らかになった。ミリストイル化蛋白質はラフトで機能する主要構成因子であり、細胞の状態に応じて膜画分と細胞質を移行することで、二つの領域間のシグナル伝達を担っている。神経細胞膜ラフトにも、脳特異的ミリストイル化蛋白質である、MARCKSやNAP22が可逆的に集積することが知られている。
研究の背景
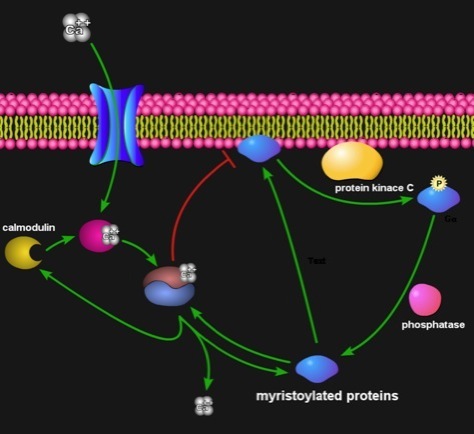
神経細胞の刺激応答に際して、誘引性、または、反発性ガイダンス分子により神経細胞が突起を延ばすが、このとき、NAP22を含むMARCKSファミリー蛋白質がアクチン、等の細胞骨格形成因子と恊働することで、通常の体細胞に見られるような固定化されたものとは異なる、細胞の迅速な外部環境への応答を可能とするような、特殊な細胞骨格を形成していると考えられている。近年、神経細胞膜上のラフトにMARCKSファミリー蛋白質が可逆的に集積することが示唆された。生体膜ラフトは細胞内シグナル伝達経路上のクロストークポイントであり、迅速かつ効率的なシグナリング処理を可能とする機能場だと予想される。神経細胞に特異的な細胞骨格の柔軟性と迅速な形成と崩壊を可能としているのは、生体膜ラフトにおける細胞内シグナル伝達系の神経細胞に特化した処理メカニズムであると考えられるが、そこで何が起きているのかは、ほとんど解っていない。しかしながら、MARCKSファミリー蛋白質以外にも、src遺伝子産物pp60c-src、等、多数のミリストイル化蛋白質が生体膜ラフトに存在することが解っており、ミリストイル化蛋白質の膜画分と細胞質領域の可逆的な移行能力がラフトの機能に重要な役割を果たしていることが強く示唆される。
神経細胞をNGF(神経成長因子)や、PMA(ホルボールエステル)、カルシウムイオノフォア、等で刺激した際の、神経特異的ミリストイル化蛋白質であるNAP22とMARCKSや、細胞内シグナル伝達系の主要因子でありラフトへの局在が知られているSrcキナーゼの位置、機能構造、相互作用をマイクロラボ化した細胞で調べることでラフトの動作メカニズムを明らかにし、神経細胞の特異的な機能の分子基盤、特に、神経細胞が外部からのシグナルを最初に受け取り処理するときの分子メカニズムを明らかにする。
サブテーマ1:神経細胞膜ラフトの作動原理の解明
HIVnef遺伝子産物(Nef)が、エイズの発症に必須であることが近年明らかにされ、感染阻止が難しいエイズの治療における標的となし得ることが解ってきた。しかしながら、ミリストイル化されているということ以外には、その分子機能についてはほとんど解っていない。近年、新たに開発したミリストイル化の予測アルゴリズムにより細胞内ミリストイル化タンパク質のデータベースを作成したが(http://mendel.imp.univie.ac.at/myristate/myrbase/)、このアルゴリズムを用いると膨大な数のNef変異体の総てがミリストイル化されていることが分かった。さらに、タンパク質のミリストイル化ドメインには、1)膜との相互作用、2)カルモジュリンとの相互作用、3) プロテインキナーゼCによるリン酸化が、それぞれが排他的に作用し、複数のシグナル伝達系のクロストークのプラットホームとなることで膜画分ー細胞質間のシグナリングを制御する能力があることを明らかにしたが、Nefの場合には、感染宿主細胞内在性の膜画分ー細胞質間シグナル伝達系に、Nefがそのミリストイル化ドメインを使って介入していると考えられた。
本研究では、Nefのミリストイル化ドメインの機能に着目して、細胞の状態に応じてこの機能ドメインのリン酸化やカルモジュリンとの相互作用がどのように変化し、その時に何処にNefが移行して何と相互作用しているのかを調べることにより、Nefの未知の機能を同定する。これにより、AIDSウイルスの感染宿主であるT細胞内細胞質画分―膜画分間シグナリングへNefがどのように介入し、宿主細胞を乗っ取るのか、そのメカニズムを解明することを目的とする
サブテーマ2:免疫細胞膜ラフトの作動原理の解明